组会的全合成分析(三)
组会的全合成分析(三)
前言
本系列为慕尼黑工业大学Storch组每周五习题课教学内容的解析。
目前主要的内容就是通过一步步分析公布的全合成的细节来保持我们对于有机化学反应的敏感度,温故知新。
Total Synthesis of (+)-Kalmanol
doi: https://doi.org/10.1002/anie.202407215
摘要
Kalmanol 是 kalmane 二萜家族的代表成员,具有复杂且高度氧化的 5/5/8/5 四环骨架,含有九个连续的立体中心,表现出显著的镇痛效果和心脏毒性。我们通过 22 步反应以 2.3% 的产率成功实现了 (+)-kalmanol 的全合成。该合成包括通过钌催化的 [5+2+1] 环加成反应构建 5/5/8 三环骨架,以及精心设计的 5/5/8/5 四环骨架的立体选择性氧化序列。
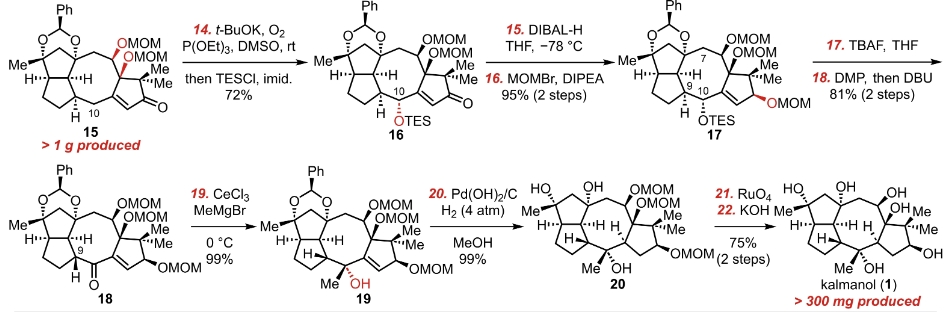
我们的合成从中间体3开始。
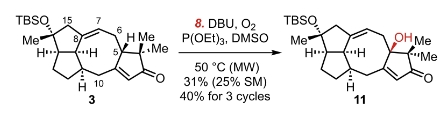
在这个反应中,实验人员选择了大量的DBU和DMSO当做溶剂,提供了一个极为碱性的反应环境。当我们重新观察这个中间体3,我们需要从中间找到一个有较强酸性的氢。在五号碳上面的氢原子应该就是这个分子中酸性最强的氢。在拔氢之后,这个碳上的电荷可以被αβ不饱和酮的共轭转移掉。此时我们注意到,三乙氧基膦在这个反应中间起到的是一个还原剂的作用。通常它会被氧化,形成三乙基磷酸酯的副产物。于是乎我们可以用碳负离子进攻氧,形成一个过氧化物负离子。这个过氧化物负离子会被磷原子的电子对捕获,而导致过氧键的断裂。生成对应的氧化物和醇。
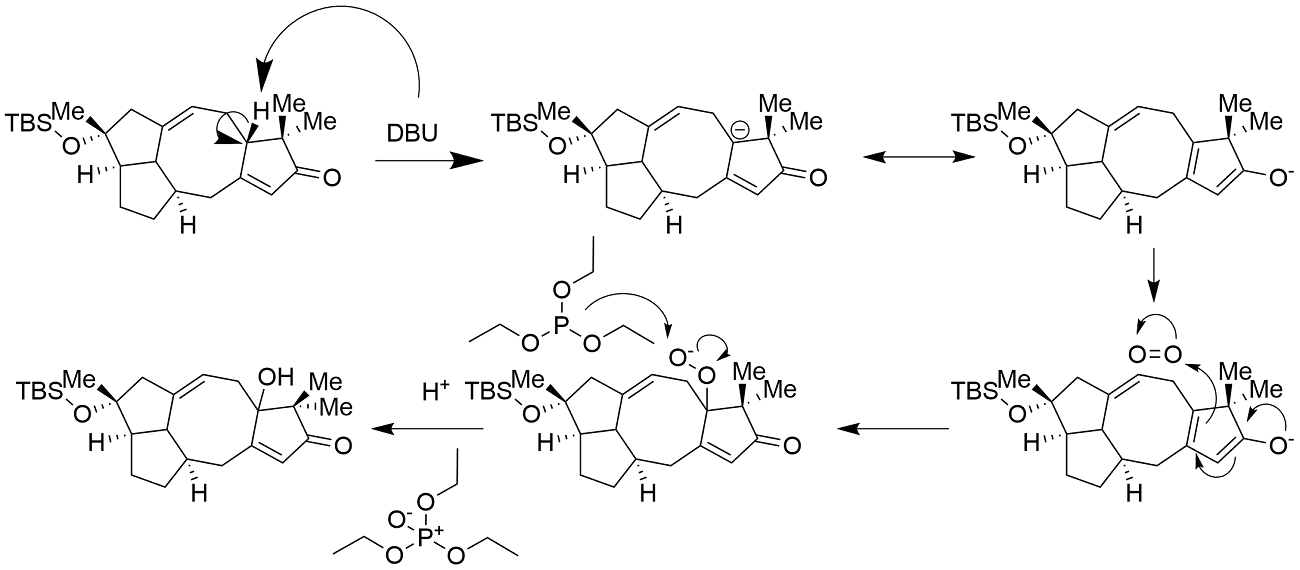
下一步是一个简单的在14二氧六环中进行的脱tbs反应。得到中间体12。
下一步反应是一个Fe(acac)3参与的非典型Mukaiyama羟基化反应。Mukaiyama羟基化反应用三乙基硅烷作为负氢还原剂,用氧气氧化Co(acac)2,这个配合物中钴是正二价,在氧化之后得到正三价的钴氢配合物,随后加成到双键上,得到一个新的氢化后碳钴中间体。这个中间体自氧化还原,得到二价钴和碳自由基。碳自由基加成到氧气上,新生成的氧自由基再和二价钴反应得到三价钴配合物。最后三价钴和三乙基硅烷交换配体得到正三价的钴氢配合物和双键与水的马尔科夫尼科夫加成产物。
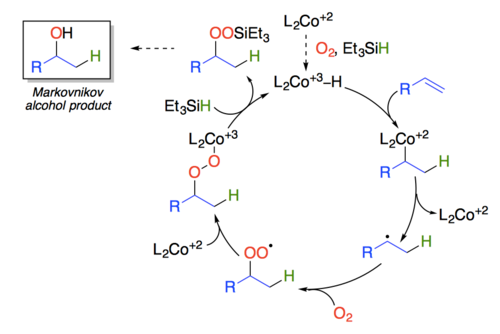
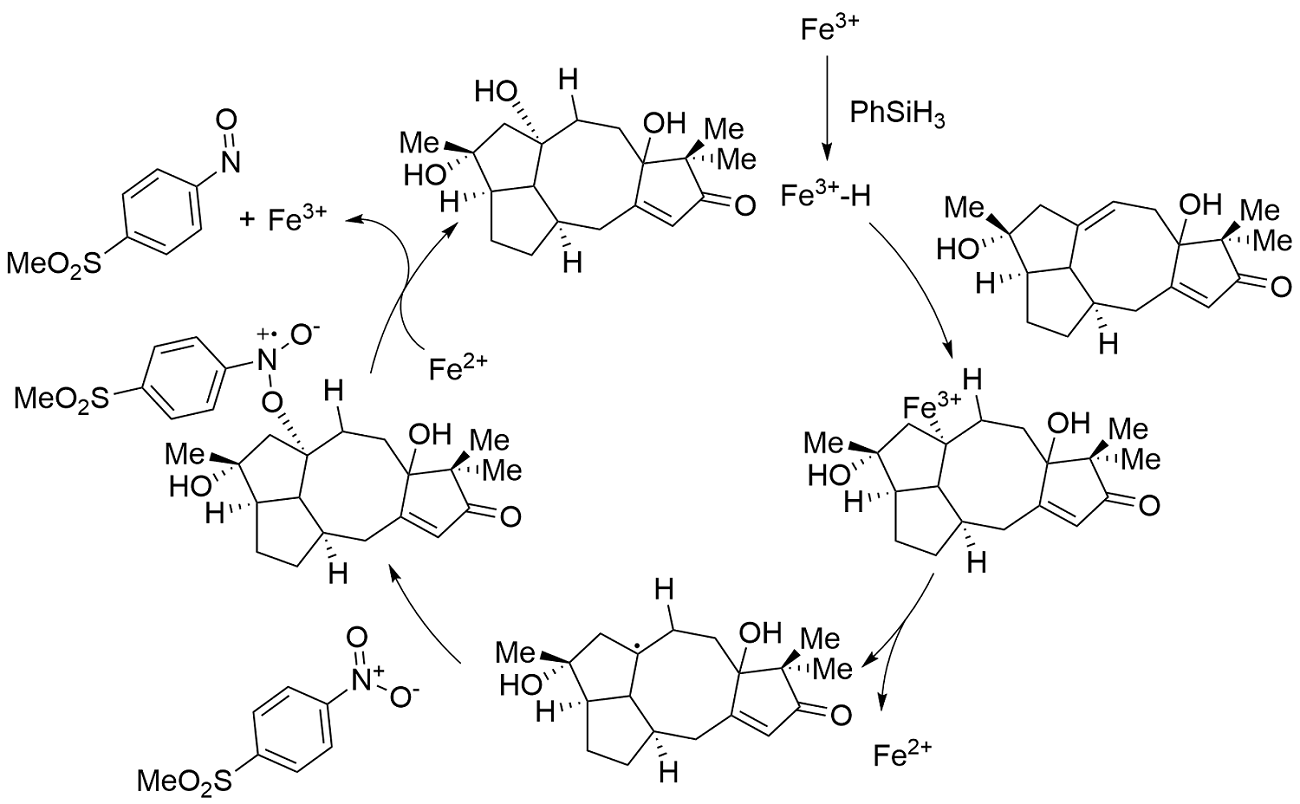
但是在这篇文章中,他们并没有使用钴配合物作为催化剂,而是使用三价铁配合物、苯基硅烷作为还原剂和对硝基苯磺酸甲酯作为氧化剂。在这个反应中前两步的铁氢配合物生成以及加成到双键上是类似于经典的Mukaiyama羟基化反应,但随后生成的碳自由基和对硝基苯磺酸甲酯的硝基发生反应,加成到硝基上的同时得到的新的氧自由基。在这之后进行的反应就又类似于经典的羟基化反应了。这个羟基的绝对构型是因为硝基和16号碳上面的羟基形成了氢键链接,所以羟基被固定在同面。
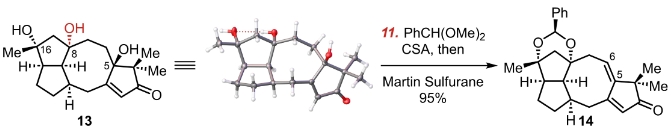
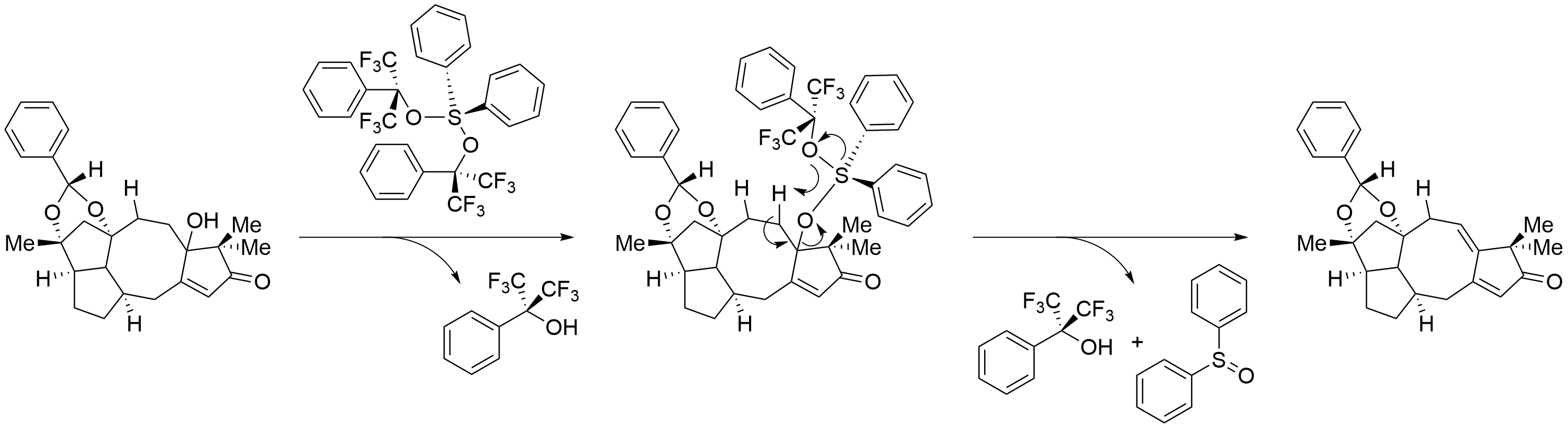
这两个羟基在CSA(樟脑磺酸)的催化作用下被苯甲醛二甲缩醛保护起来。之后使用了马丁硫烷脱水。马丁硫烷是一个超价化合物,常用来进行醇的脱水生成双键。
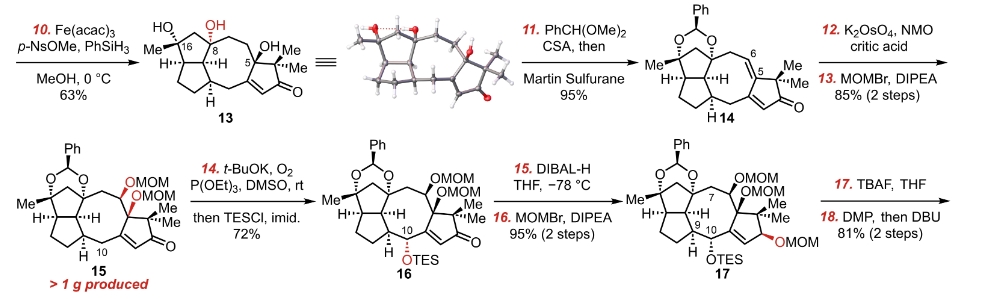
锇酸钾。锇酸钾是经典的不对称同面烯烃的双羟基化反应材料。由于四氧化锇具有强挥发性和毒性,所以经常使用催化剂量的锇酸钾和化学计量的氧化剂的组合,在溶液体系中产生催化剂量的四氧化锇来进行该反应。这个反应形成四氧化锇五元环中间体,随后水进攻锇原子,形成锇酸根后分离出同面的偕二醇。这个偕二醇后来被MOMCl在DIPEA存在下保护起来了。
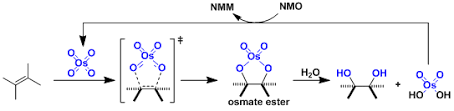
下一步的条件和中间体3到11的反应条件很类似,故不再赘述了。
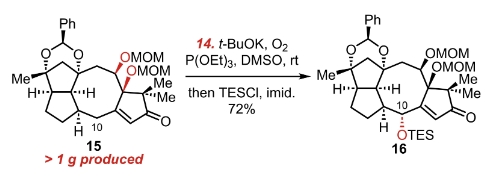
DIBAL-H还原羰基,并用MOM保护住。
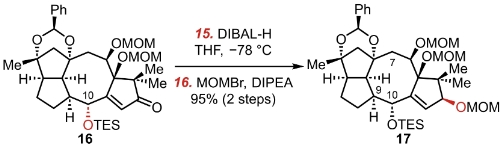
TBAF在THF里面脱TES的保护,之后一步是用DMP(Dess-Martin-Periodinane)进行醇的氧化,氧化成酮。下一步是用DBU进行的异构化?之前这个α氢是面朝下的,而C10是面朝上的,与C7形成船式构型。不是最优构型。异构化之后得到椅式构型。这个能量差为该反应的驱动力。